鑒定過程共進行兩次實驗,約30多種蛋白質被鑒定出來,已鑒定的蛋白質如表1所示,其中紅色標注的蛋白又通過MIDASTM確認。兩次實驗結果相比較,重疊率低于75%。許多在第一次實驗中被鑒定但可信度較低的蛋白質,第二次實驗中并未產生更多的MS/MS圖譜,沒被再次鑒定出來,增加了鑒定與驗證確認的難度。例如:在第一次實驗中被鑒定的蛋白質RBM17 (RNA binding motif protein 17)(表1,#24),其鑒定結果僅被一個高分值的多肽(LLQSQLQVK)所支持,并經人工分析后鑒定出來(如圖4所示)。但在第二次實驗中,該蛋白質并沒有被再次鑒定。此例說明需要更可靠的方法來驗證并確認它在樣本中是否真實存在。此應用實例中,選擇表1中紅色標示的4個蛋白質進行MIDASTM驗證,確認其是否真實存在于樣本中。
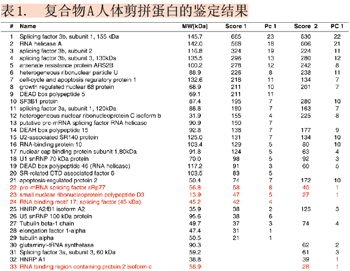
圖4. 被鑒定的蛋白質RBM17,其鑒定結果僅被第一次LC-MS/MS實驗的一個高分值的多肽所支持。
實驗方法
樣品制備
樣品根據以前的方法制備[6]。簡要的說,mRNA剪拼體復合物通過親和純化,而后通過甘油梯度離心后,樣本被分離成亞復合物。這些亞復合物經過SDS-PAGE分離后,用考馬斯亮藍染色。整個樣本電泳泳道用胰蛋白酶進行?位酶解后,萃取并凍干酶切產物肽段。
高效液相色譜分離
酶切產物肽段用納升級液相色譜(LC Packing 整機系統,Dionex公司)分離。經過C18預柱脫鹽后,通過C18分析柱(75mm×15cm, PepMap, Dionex)分離。分離條件:5%~40%乙腈,0.1%甲酸,流速200nl/min,60min梯度洗脫。
MIDASTM工作流程設計器
每一個需要被進一步確認的蛋白質,其胰蛋白酶酶切后的肽段作為母離子被Q1選擇出來,經過Q2碎裂后,在Q3中高特異性的檢測其碎片離子。只有當上述三個四級桿的掃描條件同時滿足時,信號才被記錄。因此,上述MRM掃描模式是LC-MS/MS在復雜體系樣本中最靈敏且選擇性最高的檢測技術。由于每個MRM傳輸只需5~50ms的駐留時間(Dwell time),所以一次運行中可以同時檢測多達300個分析物,大量不同的多肽可以同時被掃描檢測(如圖5所示)。

圖5. MRM引導的MIDASTM工作流程圖,所有預期的胰酶酶切蛋白質所產生的多肽通過MRM掃描模式監測,驗證其是否存在,一旦信號被檢測到,儀器會立刻自動切換到高靈敏度MS/MS采集,從而確認蛋白質的真實性。
胰蛋白酶酶切后的多肽與它們的碎片離子所構成的母-子離子對,可以通過MIDASTM工作流程設計器軟件計算出來。根據用戶輸入的蛋白質序列,此軟件可自動計算并構建MRM掃描模式所需的母/子離子對,且不需要合成多肽或蛋白質參照物來設計MRM掃描條件。
質譜配合MIDASTM方法檢測
使用NanoSpray離子源配合4000 QTRAP
LC-MS/MS進行MIDASTM檢測。
數據庫檢索參數
驗證過程中使用MASCOT 1.9(Matrixscience Ltd.)數據庫檢索引擎,檢索NCBInr蛋白質數據庫。簡要參數設置如下:MS tolerance 0.2,MS/MS tolerance 0.3,Missed cleavages 0,No variable modefications。
結果
目標蛋白質驗證與確認結果
此實驗中所選擇的4個蛋白質,MIDASTM工作流程設計器計算得出83個母/子離子對用于分析。此83個母/子離子對在實際LC-MS/MS實驗中不斷地被檢測到(如圖6上圖所示)。實驗中,一旦MRM掃描出現信號,指示有多肽母離子從色譜柱中洗脫出來,質譜儀立即切換至MS/MS掃描模式(每個肽段母離子,最多采集3次MS/MS圖譜數據),采集到的數據經數據庫檢索后,用于再次確認洗脫下來的多肽是否是來自預期的蛋白質。
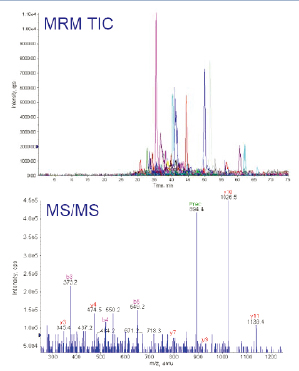
圖6. MIDASTM工作流程確認實驗,通過83個母/子離子的提取離子質量色譜圖(XIC)確認4個蛋白質(上圖),得到雙電荷m/z894.4的MS/MS譜圖的碎片離子確認RBM17的多肽序列為CVIFEIPGAPDDEAVR(下圖)。
由于線性離子阱具有極高的靈敏度,即使在MRM掃描中非常低的離子信號,在線性離子阱MS/MS掃描中也可以獲得高質量的MS/MS圖譜來驗證確認蛋白質。如圖6下圖所示,即使是豐度很低的肽段(CVIFEIPGAPDDEAVR),它的MS/MS圖譜質量仍然很好,可以清晰地看到從脯氨酸氨基端碎裂而形成的y10離子。
數據庫檢索結果
通過MIDASTM方法,樣本中被選擇進行驗證與確認工作的4個低豐度蛋白質都以高分值被驗證,每個被確認的蛋白質MASCOT分值都高于100(圖7上圖所示)。蛋白質RBM17,被5個高分值的多肽所確認。其氨基酸覆蓋率達到13.7%(圖7)。
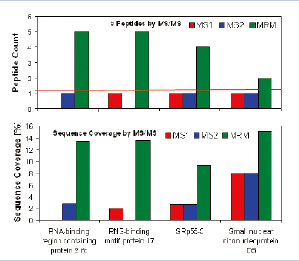
圖7. 在MASCO檢索結果中4個低豐度蛋白質都以高分值被驗證(上圖)。此外,蛋白質RBM17被5個分值都大于15的多肽序列所確認(下圖)。
由于MIDASTM工作流程的高選擇性與靈敏度,即便是在常規Nano-LC-MS/MS實驗中模糊的鑒定結果,都可以準確地被驗證其在樣本中是否真實存在,避免了假陽性的結果,如圖8所示。
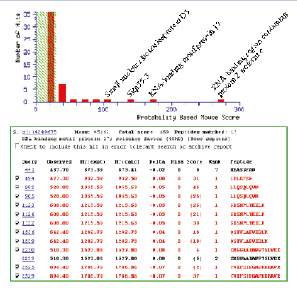
圖8. 4種目標蛋白質確認結果總結,藍色和紅色柱狀圖為標準LC-MS/MS 實驗,綠色為MIDASTM工作流程確認結果。
結論
由于MRM采集方式的高選擇性與靈敏度,非常適合在動態變化且體系復雜的樣本中驗證低豐度蛋白質的存在。
在此項實驗中,結合4000
QTRAP線性離子阱串聯三級四極桿質譜系統,基于MRM的MIDASTM技術方案成功驗證了低豐度的4個蛋白質確實存在于人體mRNA剪拼體復合物中。與常規Nano-LC-MS/MS質譜儀蛋白質鑒定實驗相比,由MRM引導的線性離子阱MS/MS掃描顯著提高了氨基酸覆蓋率,增強了可信度與準確性(圖8)。
MIDASTM技術方案充分利用了QTRAP這類(線性離子阱串聯三級四極桿)質譜系統的功能特點,既通過其三級四極桿的MRM掃描模式驗證存在性,又利用其線性離子阱MS/MS掃描靈敏度高的特點確認真實性。因此,MIDASTM技術方法將在生物標志物的驗證與確認領域發揮越來越重要的作用。
【參考文獻】
1. Baldwin MA, Mol. Cell. Proteomics 3, 1-9 (2005).
2. Panchaud A, Kussmann M and Affolter M, Proteomics 5, 3836-46 (2005).
3. Chamrad DC, koerting G, Stühler K, Meyer HE, Klose J and Blüggel M, Proteomics 4, 619-28 (2004).
4. Unwin RD, Griffiths JR, Leverentz MK, Grallert A, Hagan IM and Whetton AD, Mol. Cell. Proteomics 4, 1134-1144 (2005).
5. Cox DM, Zhong F, Du M, Duchoslav E, Sakuma T and McDermott JC, J. Biomol. Tech. 16,83-90 (2005).
6. Hartmuth K, Urlaub H, Vornlocher HP, Will CL, Gentzel M, Wilm M and Lührmann R, PNAS 99, 16719-24 (2000)
來自蘇黎世聯邦理工學院的研究人員開發了一種新程序可用于測試癌癥生物標記物的臨床利益。這種方法可能會大大縮短從實驗室到進入臨床應用的道路。相關論文發表在7月11日的《科學轉化醫學》(ScienceTra......
從復雜的生物基質中直接富集、保存和篩選痕量的生物標志物一些問題已阻礙了發現和確證更好的生物標志物,比如復雜的分離和富集,很難分析痕量的化合物,樣本中可能包含許多豐度蛋白質等。島津科學儀器的合作伙伴——......
賽默飛世爾科技質譜技術幫助波士頓兒童醫院識別兒童急性闌尾炎的生物標志物兒童醫院的研究團隊相信該發現將帶來更為準確和有效的診斷圣何塞,加州(2009年12月14日)–世界領先的科學服務商賽默飛世爾科技公......
【導語】第十一期質譜沙龍活動中,中科院過程工程所生化工程國家重點實驗室的張貴鋒博士,給我們做了《HPLC/MS在膠類藥物質量控制中的應用》的報告,各屆反響強烈。今日,分析測試百科網的記者再次走近張博士......
2008年12月21日下午,質譜沙龍第十五期活動在第二炮兵總醫院遠程會診中心會議室舉行。來自發酵研究院、清華大學、二炮總醫院、朝陽醫院、北大醫學院、北醫三院、安貞醫......
北京大學與比利時根特大學合作研究項目——肝癌患者血清學標志物,近日取得階段性成果,其論文《乙型肝炎病毒引起的肝硬化肝癌患者糖組學的改變》發表在《美國肝臟病學雜志》上。 合作項目中方負責人、北......
來自紐約5月29日的消息,美國生物芯片制造商Fluidigm公司宣布香港中文大學化學病理學系(DepartmentofChemicalPathology)獲得了其BioMark實時PCR系統的ZL許可......
世界華人消化雜志2008年12月8日;16(34):3877-3883文獻綜述REVIEW代謝組學及其在腫瘤生物學研究中的應用進展Metabonomicsandits appli......
......